微生物所研究团队在靶向KRAS突变的TCR-T免疫疗法及TCR识别机制方面取得进展
Kirsten 鼠肉瘤病毒癌基因同源物(Kirsten Rat Sarcoma Viral Oncogene Homolog, KRAS)是多种肿瘤中最常见的突变基因,KRAS 突变,尤其是最常见的密码子12和13突变,促进肿瘤细胞代谢重编程、细胞增殖和生存。KRAS突变被广泛认为是实体肿瘤治疗最有前景的靶点之一,但由于其缺乏有效药物作用位点,一直以来被称为“不可成药靶点”。
10月12日,中国科学院大学研究人员在期刊《Nature Communications》上发表题为“KRAS G12V neoantigen specific T cell receptor for adoptive T cell therapy against tumors”的研究论文,研究结果揭示了KRAS-G12V突变肽的呈递和TCR识别的机制,并描述了具有治疗潜力的TCR用于肿瘤免疫治疗,为 KRAS 突变肿瘤的免疫治疗药物开发奠定了重要基础。

团队筛选了两个HLA-A限制性KRAS-G12V突变新抗原特异性的TCR,并命名为1-2C和3-2E TCR,实验表明这些TCR能够特异性识别KRAS-G12V突变,还发现其对肿瘤细胞能够产生特异性细胞因子分泌和细胞毒性杀伤作用,而且这两个TCR对人基因组同源多肽无交叉反应性,表明其对KRAS-G12V识别的高特异性及较低的交叉反应风险。
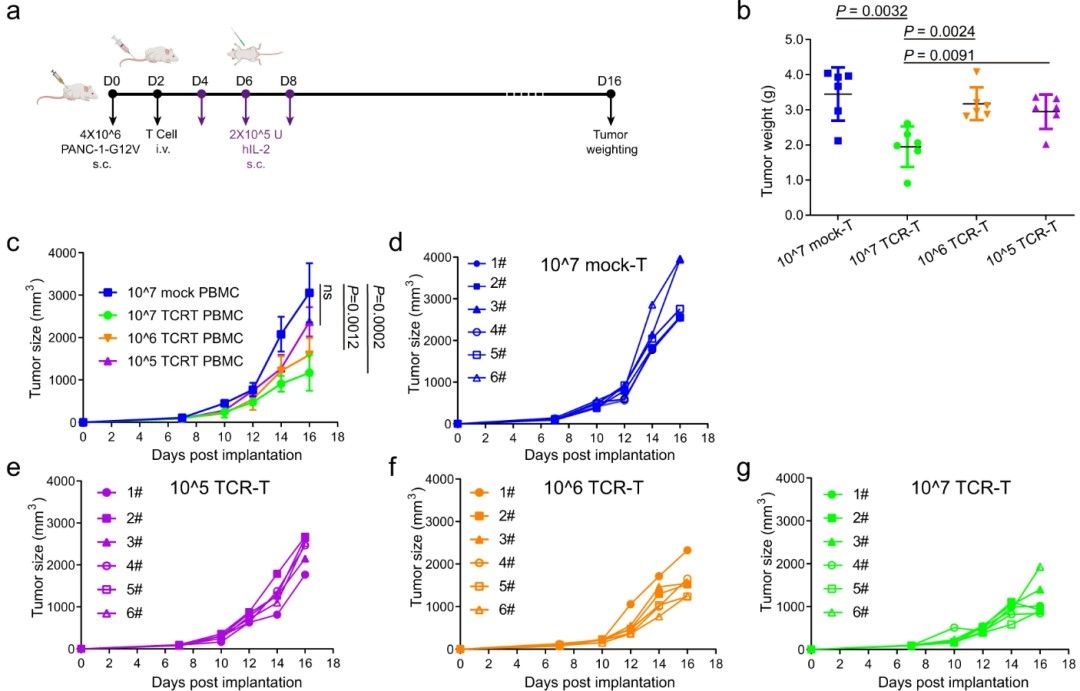
研究人员通过小鼠肿瘤模型对1-2C TCR-T细胞的肿瘤抑制活性进行了系统评价。通过不同剂量1-2C TCR-T细胞对PANC-1胰腺癌模型的抑瘤活性评价,发现中、高剂量TCR-T细胞具有显著的肿瘤抑制活性。进一步在SW620结直肠癌模型中的评价,发现1-2C TCR-T细胞与PD-1抗体联用具有显著的协同肿瘤抑制活性,且观察到其在体内能够保持长效的肿瘤抑制活性。
该研究特异性针对KRAS突变体的T细胞可以通过分泌细胞因子或通过使用粒酶B和穿孔素直接杀死方式,消除带有KRAS突变的肿瘤细胞,为携带有共享KRAS G12V突变的肿瘤提供了潜在的治疗候选方案。
文献链接:https://doi.org/10.1038/s41467-023-42010-1

