Reciprocal effects of alpha-synuclein aggregation and lysosomal homeostasis in synucleinopathy models
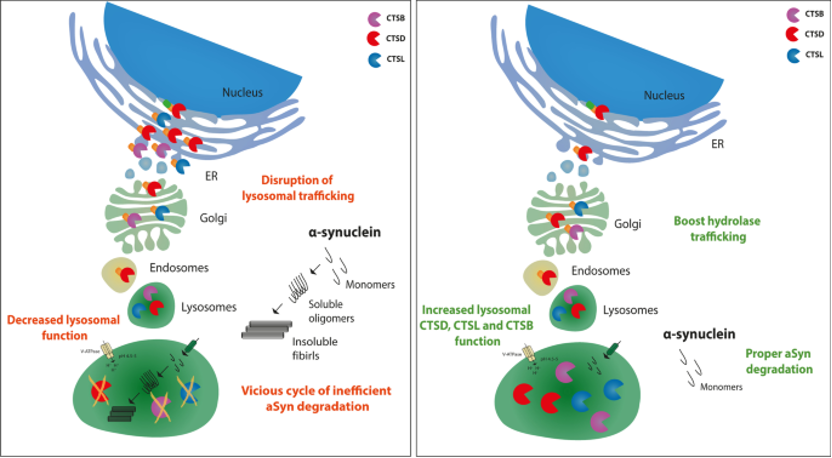
埃尔兰根大学医院的研究人员进行的一项开创性研究发现了 α-突触核蛋白聚集与溶酶体稳态之间的显着相互作用,为了解帕金森病等神经退行性疾病的机制提供了新的线索。该研究利用患者来源的多巴胺神经元和 α-突触核蛋白聚集的小鼠模型确定了溶酶体内半胱氨酸组织蛋白酶的转运受到损害,导致蛋白水解活性降低。 溶酶体的功能受损导致了 α-突触核蛋白的积累。他们还发现,高水平的 α-突触核蛋白会破坏 H4 细胞和帕金森病患者诱导多能干细胞 (iPSC) 中组织蛋白酶的运输和活性。 相反,降低 α-突触核蛋白水平会增强组织蛋白酶的成熟和细胞内运输,这可能是一种减少 α-突触核蛋白积累的潜在治疗策略。
此外,该研究还探索了一种名为 FTI(Farnesyltransferase inhibitor) 的化合物的治疗潜力,该化合物可增强溶酶体功能和组织蛋白酶活性。 研究人员发现,FTI 治疗降低了 α-突触核蛋白水平,并改善了过度表达 α-突触核蛋白的细胞中的组织蛋白酶运输和活性。 这一发现为开发帕金森病和其他相关疾病的新疗法开辟了新的可能性。
这项研究对于理解神经退行性疾病的潜在机制具有重要意义。 溶酶体功能失调和 α-突触核蛋白降解受损导致有毒蛋白聚集体的形成,导致神经元功能障碍和疾病进展。该研究还强调了 FTI 的潜在治疗作用, 这表明促进溶酶体转运可能是减少α-突触核蛋白积累和改善突触核蛋白病中溶酶体功能的有前途的策略。
文章DOI:https://doi.org/10.1186/s40035-023-00363-z